Bảng tuần hoàn nguyên tố chất hóa học có vai trò cực kỳ quan trọng. Nếu các em hy vọng học tốt môn Hóa, thì rất cần phải “tinh thông” triết lý có vào bảng tuần hoàn. Vậy, cách đọc và cách ghi ghi nhớ bảng tuần hoàn hóa học lớp 8, lớp 9, lớp 10 như thế nào? spqnam.edu.vn Education sẽ ra mắt đến những em tất tần tật về bảng tuần hoàn những nguyên tố hóa học qua bài viết sau. Bạn đang xem: Hình ảnh bảng tuần hoàn hóa học

Một số tin tức về bảng tuần hoàn trong chương trình lớp 10 của Mendeleev:
Khi các nguyên tố new được tìm kiếm thấy, bảng tuần trả cũng trải qua không ít lần điều chỉnh. Tuy nhiên, các hiệ tượng hiển thị cơ bạn dạng vẫn được không thay đổi như thiết kế lúc đầu của Mendeleev. Giá trị chủ chốt mà bảng tuần hoàn nguyên tố hóa học đem lại đó là khả năng phân tích đặc thù hóa học của một nguyên tố cụ thể dựa vào địa điểm trong bảng. Ngoài việc được áp dụng lúc học Hóa, bảng tuần hoàn cũng được sử dụng vào 2 môn Lý với Sinh.Cách coi bảng tuần trả hóa học

Cấu chế tác bảng tuần hoàn những nguyên tố hóa học
Ô nguyên tố: Thể hiện các thông tin về số hiệu nguyên tử, ký kết hiệu hóa học, thương hiệu nguyên tố, nguyên tử khối của nguyên tố chất hóa học trong ô.Chu kỳ: Dãy những nguyên tố chất hóa học được xếp theo chiều tăng đột biến về năng lượng điện hạt nhân và những nguyên tử của chúng bao gồm cùng số lớp electron. Có toàn bộ 7 chu kỳ luân hồi trong bảng tuần trả nguyên tố hóa học, chu kỳ 1, 2, 3 điện thoại tư vấn là chu kỳ luân hồi nhỏ, chu kỳ 4, 5, 6, 7 hotline là chu kỳ lớn.Nhóm nguyên tố: Tập hợp các nguyên tố có đặc điểm tương tư nhau vì trong nguyên tử của chúng gồm cùng số electron phần ngoài cùng cùng được xếp thành cột theo chiều tăng mạnh của năng lượng điện hạt hiền khô dưới lên trên.Chi tiết của một ô nhân tố trong bảng tuần hoàn nguyên tố hóa học
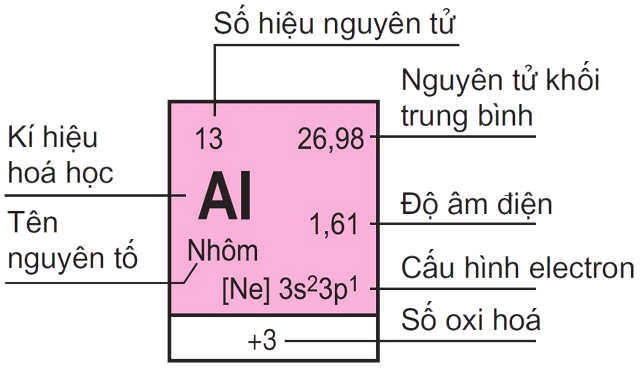
Để câu hỏi xem bảng tuần trả hóa những nguyên tố hóa học lớp 10 tiện lợi và chuẩn chỉnh xác, những em buộc phải làm quen với một trong những thuật ngữ như bên dưới:
Số hiệu nguyên tử: Còn có tên gọi khác là số proton của yếu tố hóa học. Danh trường đoản cú này biểu hiện cho số proton của một nguyên tử cùng số điện tích của phân tử nhân. Số hiệu nguyên tử có giá trị ngay số electron vào một nguyên tử trung hòa - nhân chính về điện. Đặc biệt, số hiệu nguyên tử để giúp đỡ xác định độc nhất vô nhị một thành phần hóa học. Nguyên tử khối trung bình: Hầu hết, các nguyên tố hóa học số đông là hỗn hợp của rất nhiều đồng vị khác nhau, có tỉ lệ tỷ lệ số nguyên tử xác định. Vày đó, nguyên tử khối của các nguyên tố này sẽ tiến hành tính bởi nguyên tử khối vừa đủ của tất cả hổn hợp đồng vị dựa vào tỉ lệ tỷ lệ của các nguyên tử tương ứng.Cấu hình electron: Cho thấy sự phân bố của những electron ở phần đa trạng thái năng lượng không giống nhau trong lớp vỏ nguyên tử hoặc ở phần lớn nơi mà bọn chúng hiện diện.Độ âm điện: Là năng lực hút electron trong quy trình tạo thành link hóa học. Về phần này, các em đề xuất ghi nhớ rằng độ âm điện tỉ lệ thuận với tính phi kim. Cụ thể, giả dụ độ âm năng lượng điện của thành phần càng lớn, tính phi kim càng mạnh khỏe và ngược lại. Số oxi hóa: Là số sử dụng cho một hoặc 1 team nguyên tử. Dựa vào con số này, những em hoàn toàn có thể tính được số electron đàm phán khi gia nhập phản ứng.Tên nguyên tố: Gồm 1 thứ hạng nguyên tử duy nhất, được phân biệt dựa trên số hiệu nguyên tử.Ký hiệu hóa học: là tên viết tắt của yếu tố hóa học, bao gồm một hoặc 2 chữ cái Latin. Chữ thứ nhất thường đã viết hoa.Ancol Isoamylic Là Gì? công thức Ancol Isoamylic Và bài xích Tập Vận Dụng
Vị trí của oxi vào bảng tuần trả hóa học

Oxi có thông số kỹ thuật là 1s22s22p4
Vậy địa chỉ của oxi trong bảng tuần hoàn hóa học là làm việc ô lắp thêm 8; chu kỳ 2 (do gồm 2 lớp electron); đội VIA (do 6 e hóa trị, yếu tố p)
Ý nghĩa của bảng tuần trả nguyên tố hóa học
1. Lúc biết được địa chỉ của yếu tố hóa học, ta hoàn toàn có thể suy ra được tính chất và cấu trúc của nguyên tố hóa học đó.
Ví dụ: lúc biết nguyên tố X bao gồm số hiệu nguyên tử là 16, thuộc chu kỳ 3, team VIA, ta hoàn toàn có thể suy ra được:
Điện tích phân tử nhân của nhân tố X là 16+ cùng nguyên tố này có 16 electron (số hiệu nguyên tử là 16)Nguyên tố X tất cả 3 lớp electron (thuộc chu kỳ 3).Lớp kế bên cùng của nhân tố X gồm 6 electron (thuộc đội VIA).2. Khi biết được cấu tạo nguyên tử của yếu tố hóa học, ta hoàn toàn có thể suy ra được đặc thù và vị trí của thành phần hóa học kia trong bảng tuần trả nguyên tố hóa học.
Ví dụ: lúc biết nguyên tố Y tất cả điện tích hạt nhân là 12+, gồm 3 lớp electron và lớp bên ngoài cùng gồm 2 electron, ta có thể suy ra được:
Nguyên tố Y nằm tại ô thiết bị 12 (điện tích hạt nhân là 12+), thuộc chu kỳ 3 (có 3 lớp electron), team IIA (lớp ngoài cùng bao gồm 2 electron) nằm trong bảng tuần hoàn.Do nằm ở đầu chu kỳ, đề xuất nguyên tố Y là kim loại.Cách học tập thuộc cấp tốc bảng tuần hoàn hóa học
Thực tế, bảng tuần hoàn những nguyên tố chất hóa học 10 có nhiều thông tin. Hãy áp dụng 1 trong các 3 giải pháp sau để vấn đề học thuộc cùng ghi lưu giữ trở nên đơn giản dễ dàng và lập cập hơn.
Cách 1: nghiên cứu bảng tuần hoàn
Mỗi ô trong bảng tuần hoàn đã hiển thị tin tức về tên, ký kết hiệu, số hiệu nguyên tử. Chỉ việc ghi nhớ 10 nguyên tố đầu tiên, những em vẫn tìm ra quy luật cho những nguyên tố còn lại.
Cách 2: In với dán bảng tuần hoàn ở đa số nơi dễ phân biệt trong không gian học

Các em hãy dán bảng tuần hoàn ở các nơi dễ dàng quan cạnh bên và phân thành nhiều phần nhằm học. Điều này thật sự mang đến hiệu quả cao trong vấn đề ghi nhớ.
Cách 3: Dùng phương pháp để ghi nhớ
Để hoàn toàn có thể nhớ lâu kỹ năng và kiến thức trong bảng tuần hoàn, các em cần liên tục làm bài xích tập và vận dụng câu thơ/văn xuôi để ghi nhớ:
Hơn hết, để có thể nhớ lâu kỹ năng trong bảng tuần trả nguyên tố hóa học, các em cần thường xuyên làm bài bác tập và vận dụng câu thơ/văn xuôi để ghi nhớ 20 nguyên tố đầu:
tính chất Hóa học Của Clo, Ứng Dụng, Điều Chế Clo, bài bác Tập Về Clo
Hoàng hôn lặn bể Bắc
Chợt nhớ nghỉ ngơi phương Nam
Nắng mai ánh sương phủ
Song cửa ngõ ai ko cài.
| HHoàng | HeHôn | ||||||
| LiLặng | BeBể | BBắc | CChợt | NNhớ | OỞ | FPhương | NeNam |
| NaNắng | MgMai | AlÁnh | SiSương | PPhủ | SSong | ClCửa | ArAi |
| KKhông | CaCài |
Hoặc một vài câu nói học tập thuộc như: “khi nào đề nghị may áo gần kề sắt nhớ sang phố hỏi cửa hàng Á Phi Âu” tương ứng cho F, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au. “Lâu ni không thủng thẳng coi phim” khớp ứng với Li, Na, K, Rb, Cs, Pr.
Cách 4: bài ca hóa trị
Áp dụng bài xích ca hóa trị nhằm học nằm trong bảng tuần hoàn các nguyên tố hóa học:
“Kali, I – ốt, Hidro
Natri cùng với Bạc, Clo một loài
Là hóa trị 1 bạn ơi
Nhớ ghi mang đến rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cũng gần Bải
Cuối cùng thêm chú Oxi
Hóa trị 2 ấy tất cả gì khó khăn khăn
Bác Nhôm hóa trị 3 lần
Ghi sâu đầu óc khi cần có ngay
Cacbon, Silic này đây
Là hóa trị 4 ko ngày như thế nào quên
Sắt kia nói cũng thân quen tên
2, 3 tăng lên và giảm xuống thật phiền lắm thôi
Nito rắc rối nhất đời
1, 2, 3, 4 lúc thời lắp thêm 5
Lưu huỳnh lắm khi chơi khăm
Xuống 2, lên 51 khi nằm máy 4
Photpho nói tới không dư
Nếu ai hỏi đến thì hừ rằng 5
Em ơi cố gắng học chăm
Bài ca hóa trị trong cả năm cực kỳ cần”.
Bảng tuần hoàn chất hóa học rõ nét, vừa đủ nhất
Để giúp những em rất có thể học tập hiệu quả, spqnam.edu.vn Education sẽ tổng hợp những file pdf, file ảnh bảng tuần hoàn chất hóa học rõ nét, khá đầy đủ nhất lớp 8, lớp 9, lớp 10 dưới đây. Các em có thể tải bảng tuần hoàn chất hóa học về để học tập với ghi nhớ:

Bài tập áp dụng có đáp án
Bài tập SGK Hóa 9
Bài 1 Trang 101 SGK Hóa 9Nêu cấu tạo nguyên tử, đặc điểm kim các loại và đặc điểm phi kim của các nguyên tố có số hiệu nguyên tử thứu tự là 7, 12, 16.
Lời giải:
Gọi A, B, C là 3 nguyên tố gồm số hiệu nguyên tử theo yêu ước đề bài, dựa trên bảng thành phần hóa học, ta gồm bảng sau:
| Nguyên tố | Số hiệu nguyên tử | Cấu chế tác nguyên tử | Tính chất | ||||
| Điện tích hạt nhân | Số e trong nguyên tử | Số lớp electron | Số e lớp ngoài cùng | Kim loại | Phi kim | ||
| A | 7 | 7+ | 7 | 2 | 5 | x | |
| B | 12 | 12+ | 12 | 3 | 2 | x | |
| C | 16 | 6+ | 6 | 3 | 6 | x |
Cho biết yếu tắc X có cấu trúc nguyên tử với điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có một electron. Xác xác định trí của thành phần X vào bảng tuần hoàn.
Xem thêm: Lời Chúc Mùng 8 Tháng 3 - Lời Chúc 8/3 Ý Nghĩa Cho Mẹ Và Chị Em Gái
Lời giải:
Vị trí của nguyên tố X vào bảng tuần hoàn:
Ô số 11 (điện tích phân tử nhân là 11+)Chu kì 3 (3 lớp electron)Nhóm I (lớp kế bên cùng có một electron)Từ 3 thông tin trên, ta có thể kết luận:
Tên yếu tố X là Natri.Ký hiệu chất hóa học là Na.Nguyên tử khối là 23.Bài 3 Trang 101 SGK Hóa 9Đặc điểm của những nguyên tố thuộc team I các là những kim loại mạnh tương tự Natri (có khả năng tác dụng với nước sản xuất thành dung dịch kiềm giải hòa khí hidro, công dụng với oxi chế tạo thành oxit, tác dụng với phi kim khác tạo ra thành muối). Hãy viết 3 phương trình bội phản ứng minh họa cùng với Kali.
Lời giải:
Kali tính năng với nước tạo thành dung dịch kiềm và giải phóng khí hidro.2K + 2H2O → 2KOH + H2
Kali chức năng với oxi tạo nên thành oxit.4K + O2 → 2K2O
Kali tác dụng với phi kim chế tác thành muối.2K + Cl2 → 2KCl
Bài 4 Trang 101 SGK Hóa 9Đặc điểm của các nguyên tố thuốc đội VII mọi là phần nhiều phi kim mạnh tương tự như Clo (trừ At) (có khả năng tính năng với đa số kim các loại tạo thành muối, công dụng với hidro chế tạo thành hợp chất khí). Hãy viết 3 phương trình làm phản ứng minh hoạ cùng với Brom.
Lời giải:
Brom tác dụng với kim loại tạo thành muối.Br2 + 2K → 2KBr
3Br2 + 2Fe → 2FeBr3
Brom tính năng với hidro chế tạo thành hợp hóa học khíBr2 + H2 → 2HBr (k)
Bài 5 Trang 101 SGK Hóa 9Hãy cho thấy thêm cách thu xếp nào dưới đây đúng theo hướng tính kim loại giảm dần và lý giải sự lựa chọn:
a. Na, Mg, Al, K
b. K, Na, Mg, Al
c. Al, K, Na, Mg
d. Mg, K, Al, Na
Lời giải:
b là câu trả lời đúng vì
Các yếu tắc Na, Mg, Al ở cùng chu kì, theo chiều tăng mạnh điện tích phân tử nhân, tính sắt kẽm kim loại giảm.Các yếu tắc Na, K ở và một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại tăng.Bài tập SGK Hóa 10
Bài 1 Trang 35 SGK Hóa 10Các nhân tố xếp làm việc chu kì 6 có số lớp electron trong nguyên tử là:
a. 3
b. 5
c. 6
d. 7
Lời giải:
c là câu trả lời đúng.
Bài 2 Trang 35 SGK Hóa 10Trong bảng tuần hoàn những nguyên tố, số chu kì nhỏ và số chu kì to là:
a. 3 với 3
b. 3 cùng 4
c. 4 cùng 4
d. 4 với 3
Lời giải:
b là lời giải đúng.
Bài 3 Trang 35 SGK Hóa 10Số nguyên tố trong chu kì 3 cùng 5 là:
A. 8 cùng 18
B. 18 cùng 8
C. 8 với 8
D. 18 cùng 18
Lời giải:
a là lời giải đúng.
Bài 4 Trang 35 SGK Hóa 10Trong bảng tuần hoàn, những nguyên tố được sắp xếp theo vẻ ngoài nào?
a. Theo hướng tăng của năng lượng điện hạt nhân
b. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng
c. Các nguyên tố có cùng số electron hóa trị vào nguyên tử được xếp thành 1 cột
d. Cả A, B, C
Lời giải:
d là đáp án đúng.
Bài 5 Trang 35 SGK Hóa 10Tìm câu sai trong các câu sau đây:
a. Bảng tuần hoàn tất cả có các ô nguyên tố, những chu kì và các nhóm.
b. Chu kì là dãy các nguyên tố mà lại nguyên tử của chúng tất cả cùng số lớp electron, được thu xếp theo chiều năng lượng điện hạt dấn tăng dần.
c. Bảng tuần hoàn bao gồm 7 chu kì. Số thứ tự của chu kì thông qua số phân lớp electron trong nguyên tử.
d. Bảng tuần hoàn gồm 8 nhóm A và 8 team B.
Lời giải:
c là câu trả lời đúng.
Câu đúng: Bảng tuần hoàn bao gồm 7 chu kì. Số sản phẩm tự của chu kì ngay số lớp electron trong nguyên tử.














